《江苏省中小学实验知识竞赛》是江苏省中小学生实验能力大赛的子赛项和前置赛项,设初赛和复赛两个环节,均采取线上答题的形式,所有试题均为客观题,包含单选题和多选题。江苏省中小学生实验知识竞赛入口官网(https://mskzkt.jse.edu.cn)试题中包含图片和视频,为保障答题效果,请参赛学生使用电脑浏览器参与竞赛
江苏省中小学实验知识竞赛平台下载:点击下载
江苏省中小学生实验知识竞赛入口官网:点击进入
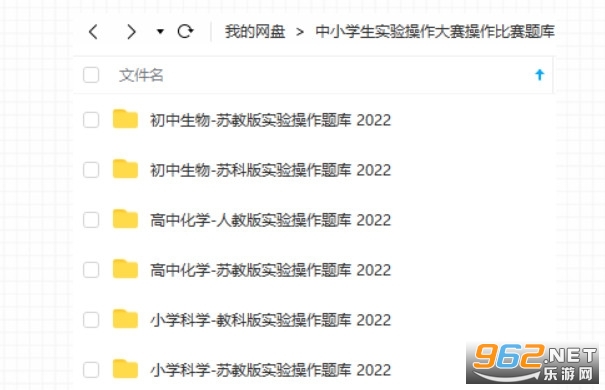
江苏省中小学实验知识竞赛题库及答案
关于发布中小学生实验操作大赛操作比赛题库的通知
根据《省教育厅办公室关于举办江苏省首届中小学生实验操作大赛的通知》(苏教办备〔2022〕1号)精神,为便于各级部门和学校开展线下实验操作比赛,我中心组织编制了相关学科实验操作题库并经过专家审核,现予以发布。有关事项通知如下。
一、题库内容
1、小学科学:苏教版、教科版五年级及以下教材中的学生实验和学生应掌握的部分基本实验操作。
2、初中生物:苏教版、苏科版八年级及以下教材中的学生实验和学生应掌握的部分基本实验操作。
3、高中化学:苏教版、人教版高二年级及以下教材(必修1、2,选择性必修1、2、3)中的学生实验和学生应掌握的部分基本实验操作。
每个实验选题均包含学生用卷和参考评分标准。
二、题库使用
实验操作题库供学校、县(市、区)和设区市组织实验操作比赛时参考。各级比赛组织单位开展实验操作比赛时可按照当地设区市的要求,结合本校、本地实际情况,直接选用题库中的实验选题,或对实验选题内容(包括学生用卷和评分标准)做修改、拓展、组合,也可以不使用题库中的实验选题另行命题。
三、题库下载
江苏省中小学实验知识竞赛怎么报名 江苏省中小学实验知识竞赛参赛指南
报名时间:4月20日10:00至5月15日21:00
初赛时间:4月25日10:00至5月15日22:00
复赛时间:5月23日16:00,高中物理学科;
5月24日16:00,高中化学学科;
5月25日16:00,初中生物学科;
5月26日16:00,小学科学学科。
注:(1)5月16日起参赛学生可登录平台查看是否获得复赛资格。
(2)除上述获得复赛机会的同学外,还有以学校为单位占本校特定年级完成初赛人数3%的完成初赛的学生有机会获得学校推荐参加复赛(由学校在平台中确认并通知有关学生)。
一、入口
(1)网页登录
江苏省中小学生实验知识竞赛以线上答卷的方式进行,入口设在“江苏中小学智慧教育平台”(原“江苏省名师空中课堂”,网址:https://mskzkt.jse.edu.cn)。
学生可通过电脑、手机等智能设备登录“江苏中小学智慧教育平台”网站,然后在“江苏省中小学生实验知识竞赛”页面(网址:https://mskzkt.jse.edu.cn/cloudCourse/syds.html)报名。因试题包含图片、视频等,为保证试题显示效果,请学生务必使用电脑参加练习、初赛与复赛(建议使用:Chrome谷歌浏览器、Microsoft Edge浏览器、360浏览器、QQ浏览器、搜狗浏览器、Firefox火狐浏览器)。
(2)手机微信公众号登录
手机微信搜索“广陵教体装备”——关注——回复“实验竞赛登录”——点击界面上“点击进入→江苏省中小学生实验知识竞赛”。
注:大赛报名时间为4月20日10:00至5月15日 21:00,请先完成江苏中小学智慧教育平台的注册以保证后续顺利报名,若您已完成注册,请等待报名开启后前来报名。若您还未注册,请先注册
二、登录“江苏中小学智慧教育平台”
进入“江苏中小学智慧教育平台”首页,使用注册手机号和密码登录。
1. 如果没有“江苏中小学智慧教育平台”的账号,可按以下操作注册:
①点击网站首页右上角【注册】;

②选择【我是学生】;
③输入姓名和学籍号后点击【下一步】,如不知道或忘记学籍号,可先用大写字母“G”+学生本人完整身份证号作为学籍号进行尝试,如仍然不对,请联系学校查询;
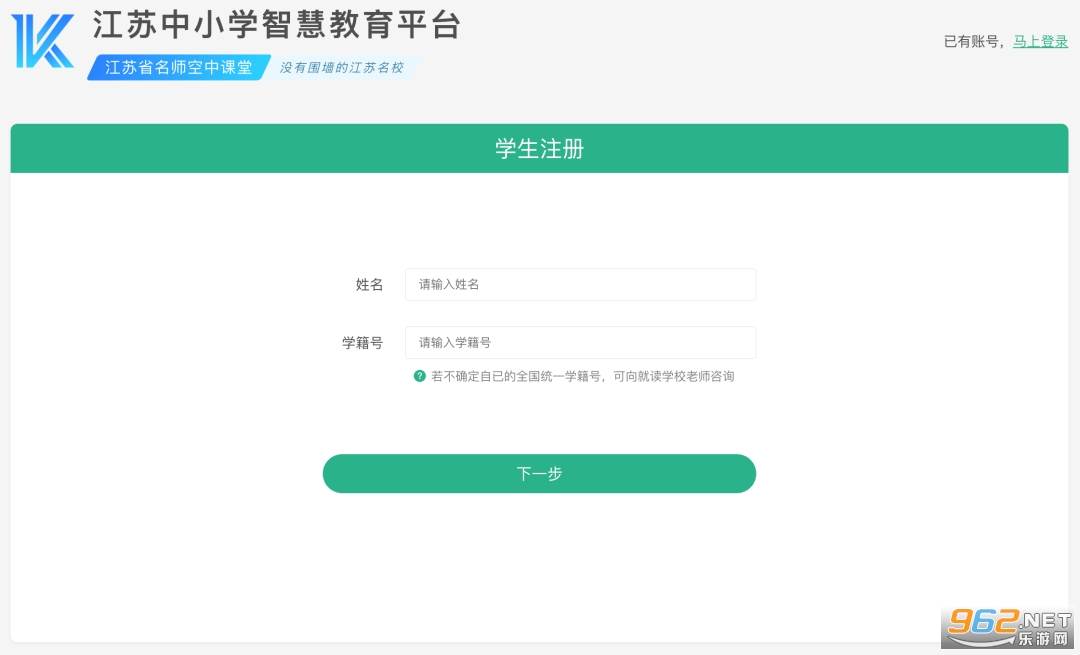
④确认学生信息是否正确,如信息有误可以修改,然后点击【下一步】;
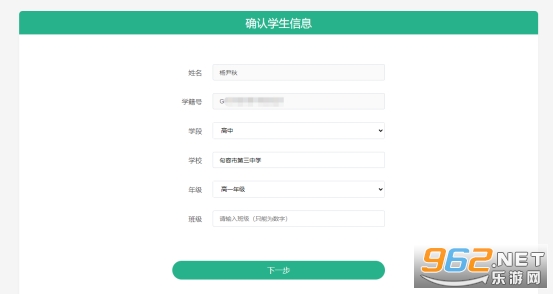
⑤绑定手机号,设置登录密码并确认密码,点击【下一步】即可完成账号注册。请学生务必牢记注册手机号和登录密码,这是学生参加竞赛活动的唯一身份认证,忘记注册手机号或登录密码,都可能导致无法正常参加竞赛活动。
2. 如果忘记密码,可按以下操作重置密码(当注册手机不在身边时将无法重置密码):
①进入登录页面点击【忘记密码】;
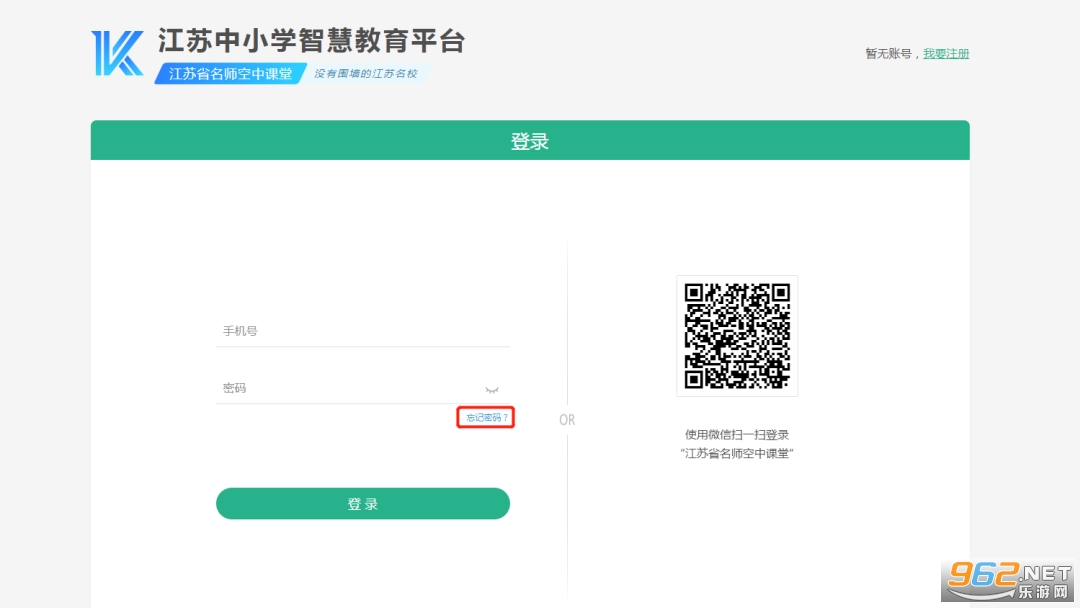
②验证手机号,设置新密码并确认,即可重置密码。

同一手机号下注册的多名同学不能在同一时间同时登陆“江苏中小学智慧教育平台”,所以请学生尽量使用不同的注册账号绑定身份,以免影响参与复赛。如果两名学生已经绑定在同一手机号下,需要其中一名学生通过重新注册账号并绑定身份。
三、报名
1. 江苏省中小学生实验知识竞赛报名时间为4月20日10:00至5月15日21:00,在此期间学生登录“江苏中小学智慧教育平台”,点击首页的“江苏省中小学生实验知识竞赛”轮播图或右侧浮窗,便可进入竞赛页面。
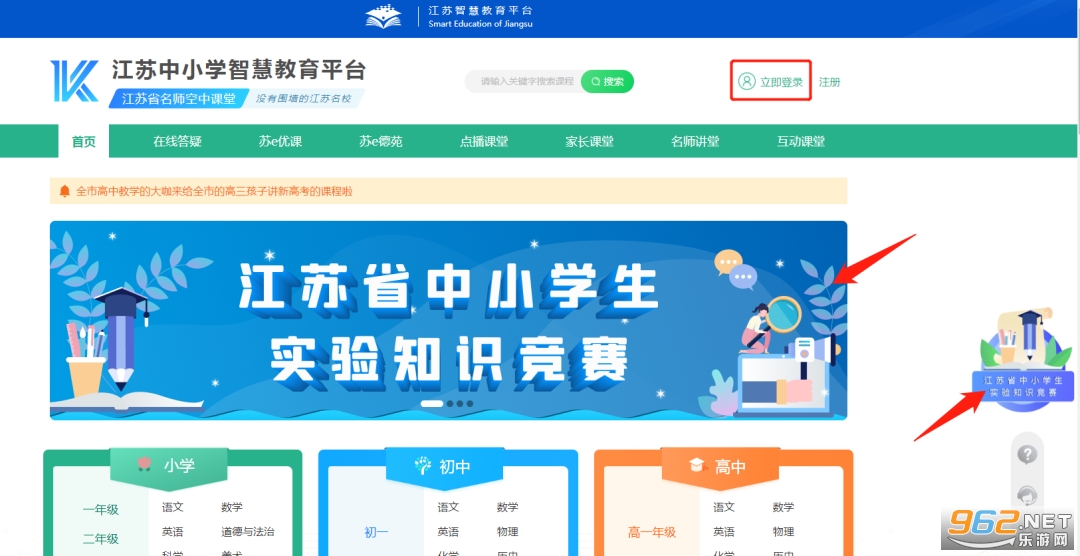
2. 进入竞赛主页后,请首先核对右上角是否为本人姓名,若姓名不是本人,可以点击“切换身份”按钮来切换。
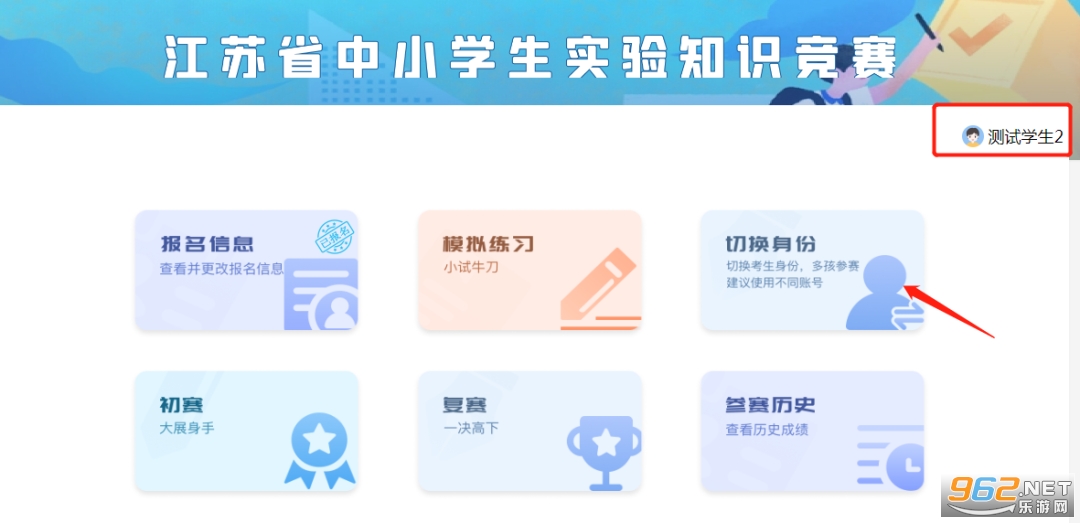

3. 学生确认个人信息后,点击“报名信息”按钮,填报报名信息并提交,报名成功后报名信息按钮会出现“已报名”图章。高中学生可以高中物理和高中化学中选择一个学科参赛,也可同时报名参加两科的比赛。
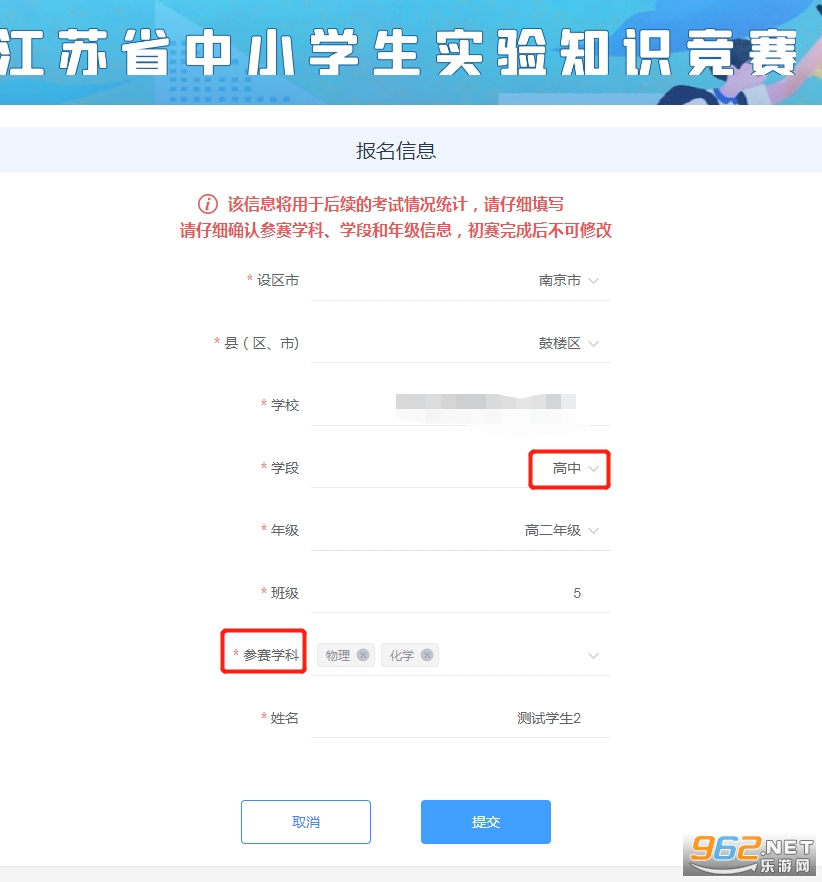

学生从报名完成至两次初赛答卷机会全部用完前,均可进入“报名信息”窗口修改参赛信息。
四、练习
为帮助参赛学生熟悉竞赛答题方式,学生从报名成功至完成初赛前,可自主选择时间进行模拟练习,练习不限次数,且分数不计入最终成绩。
学生点击“模拟练习”按钮,首先弹出的是“参赛信息”界面,确认信息无误后,点击【开始作答】即进入答题页面。若信息有误,请先返回首页,点击“报名信息”按钮修改报名信息后再参加练习。

如果学生报名参加两门学科的竞赛,则进入“模拟练习”或“初赛”时都会弹出学科选择弹窗。学生需要先选择本次要参与的学科并点击“确认”才会出现学生的参赛信息。

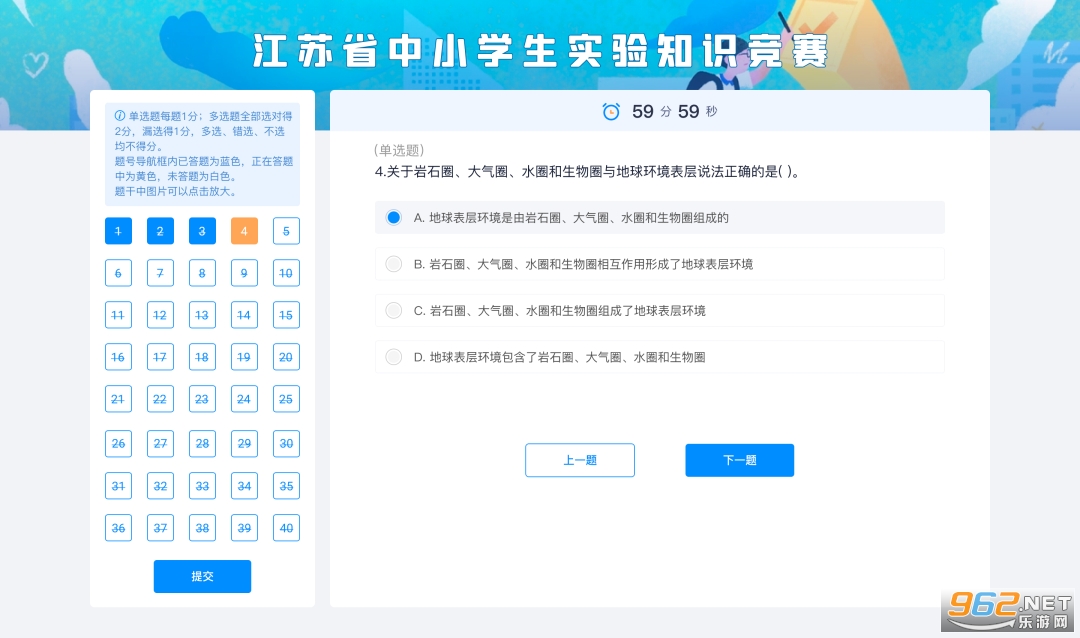
参赛学生确认信息无误后,点击“开始考试”,进入答题页面。页面上方有一个倒计时时钟,显示剩余答题时间。
每道试题均标注有题型(“单选题”或“多选题”),评分规则:单选题每题2分,选对得2分,选错或未选不得分;多选题每题3分,全部选对得3分,漏选得1.5分,错选、未选均不得分。
学生可以在左侧题号导航栏查看自己的作答进度:已答题为蓝色,正在答题中为黄色,未答题为白色。
点击【上一题】或【下一题】,或在左侧导航栏内选择题号,可以切换到其他题目。
作答完成后,点击左下角【提交】即可交卷。学生需在规定时间内完成答卷,如答题时间用完,系统将自动交卷。
答题时,如发生不慎关闭浏览器、电脑断网或死机等意外,均可重新登录系统继续答题,但断线时答题倒计时不停(即离线时间计入答题时间),重新进入答卷界面后系统按实际答题的剩余时间继续倒计时。请学生在答卷时谨慎操作,避免因意外影响成绩。
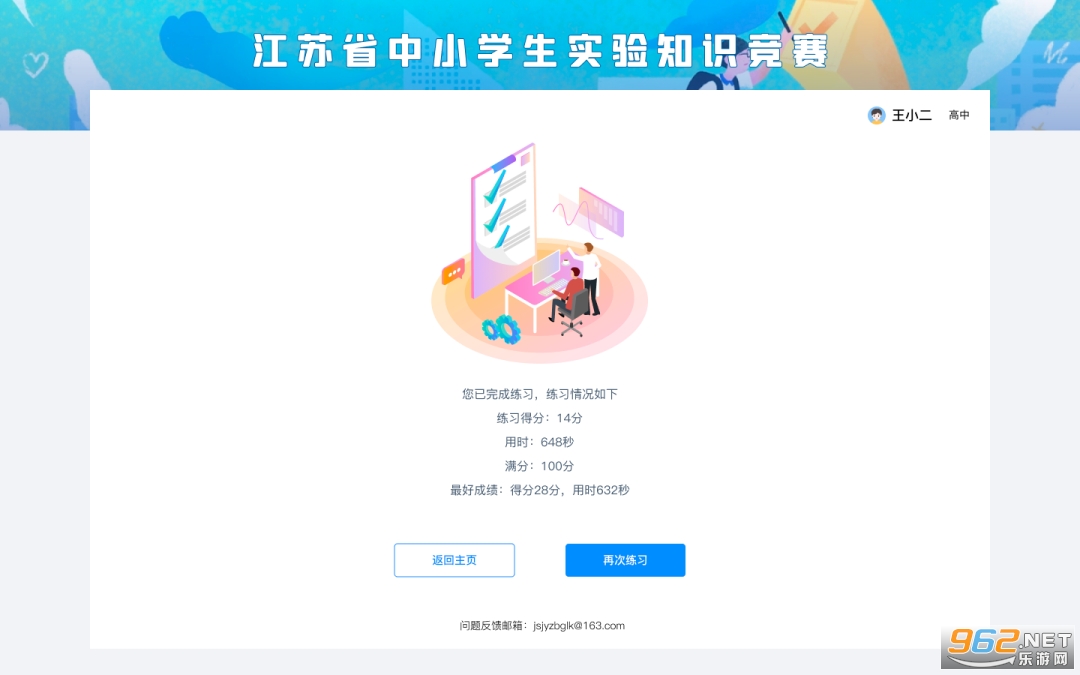
试卷由系统自动批改,学生提交试卷或答题时间用完系统自动收卷后即可显示本次作答得分和用时。
五、初赛
本次竞赛初赛开放时间为4月25日10:00至5月15日22:00,在此期间参赛学生可登录平台参与初赛,每名学生每科有两次答卷机会。两次答卷的成绩均可在【参赛历史】中查看,并取成绩较好的1次计入初赛最终成绩(答题分数相同则取用时短的1次)。初赛的参与方式、答题界面与模拟练习一致。
初赛所有答卷机会用完后(单科两次,双科四次),初赛图标会出现“已完成”图章,代表初赛答卷机会用尽。
六、复赛
初赛系统关闭后,系统会自动判断进入复赛的学生名单(以学校为单位占本校特定年级完成初赛人数的7%,特定年级指五年级、八年级或高中二年级)。5月16日起参赛学生可登录平台查看初赛结果,获得复赛资格的学生进入实验知识竞赛主页主页即可收到“恭喜XXX同学!你已获得复赛资格!”的弹窗提醒。

除上述获得复赛机会的同学外,还有以学校为单位占本校特定年级完成初赛人数3%的完成初赛的学生有机会获得学校推荐参加复赛(由学校在平台中确认并通知有关学生)。
学校将按大赛组委会要求统一时间组织学生在指定考场参与复赛,每名学生仅有一次参与机会。复赛开始时间:5月23日16:00,高中物理学科;5月24日16:00,高中化学学科;5月25日16:00,初中生物学科;5月26日16:00,小学科学学科。
学生到达考场后登陆竞赛主页,点击“复赛”按钮,可以查看本人基本信息,确认无误后,点击【开始作答】即进入复赛候考页面,复赛答题方式与初赛一致。
七、参赛历史
点击主页“参赛历史”可以查看个人过往参赛情况,若获得证书可以查看下载证书。

江苏省中小学实验知识竞赛高中化学试题
江苏省中小学实验知识竞赛高中化学试题完整版:点击查看
第26届全国高中生化学竞赛(江苏赛区)初赛试题 节选
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 S:32
Cl:35.5 Cr:50 Mn:55 Fe:56
1.本试卷共22题,用2小时完成,共120分; 2.可以使用计算器;
3.用铅笔作答无效; 4.不可以使用涂改液或修正带。 一、选择题(每小题有1~2个选项符合题意,每小题4分,共60分。请将答案填写在下方的表格内。) 题号 答案 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 1.化学知识在环境保护中起关键作用。下列叙述不正确的是 A.在燃煤中加入适量的生石灰能有效减少二氧化硫的排放 B.控制含磷洗涤剂的生产和使用有利于防止水体富营养化
C.采用汽车尾气处理技术可将汽车尾气中的NO和CO转化为无害气体 D.正常雨水呈中性,pH小于7的雨水是酸雨 2.下列化学用语正确的是
A.CO2的电子式是: B.硝基苯的结构简式:
C.中子数为8的氮原子: D.模型 可表示甲烷分子或四氯化碳分子 3.下列实验操作或装置正确的是
A.加热液体 B.制取并收集NH3 C.转移溶液 D.干燥H2 4.你认为下列数据可信的是
-
A.某胶体粒子的直径是160nm B.某常见气体的密度为1.8g·cm3
C.某反应的平衡常数是1 D.某元素的原子半径是0.160nm 5.下列推断不合理的是
A.乙烯能使酸性KMnO4溶液褪色,则丙烯也能使酸性KMnO4溶液褪色 B.铁、铝在浓H2SO4中钝化,则镁在浓H2SO4中也钝化
C.金属钠着火不能用CO2扑灭,则金属钾着火也不能用CO2扑灭
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后
加热也能恢复原色
6.设NA为阿伏加德罗常数的值,下列叙述正确的是 A.标准状况下,22.4LH2中含中子数为2NA
B.常温常压下,氧气和臭氧的混合物16g中约含有NA个氧原子 C.电解食盐水若产生2 g氢气,则转移的电子数目为2NA
-+
D.100mL 0.1mol·L1的FeCl3溶液中含有Fe3的个数为0.01NA
1
7. X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,
且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标
-
准状况下的密度为0.76g·L1;W的质子数是X、Y、Z、M四种元素质子数之和的 1/2。下列说法正确的是 A.原子半径::W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线型的共价化合物 C.由X元素形成的单质不一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 8.下列离子方程式中,错误的是
A.向A1Cl 3溶液中加入过量氨水: B.苯酚钠溶液中通人少量CO2:
C.碳酸氢钡溶液中加入过量氢氧化钠溶液: D.Fe(OH)3与氢溴酸溶液混合:
9.金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如下
图所示,下列有关绿原酸的说法正确的是 A.绿原酸的分子式为C16H8O9
B.1mol绿原酸最多与4molNaOH反应 C.1个绿原酸分子中含有4个手性碳原子
D.绿原酸分子中有4种化学环境不同的氢原子
-
10.电镀铬的废液中含有Cr2O72离子,可通过转化为铬黄加以利用。该反应放热,反
应式如下:
下列说法正确的是
A.由于该反应是离子反应,反应很快完成,温度对反应速度没有影响
B.由于该反应是完全反应,平衡常数不随反应温度的变化而改变
+-
C.增加Pb2离子的浓度,可以提高Cr2O72离子的转化率
-
D.可加入少量碱以提高pH,达到提高Cr2O72离子的转化率的目的 11.下列说法正确的是
A.放热反应一定是自发反应
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 C.pH=5的CH3COOH溶液和pH=5的NH4C1溶液中,水的电离程度相同 D.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaSO4 12.下表各组物质之间通过一步反应不能实现如图所示转化关系的是
13.Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的
废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污 染物p-CP,控制p-CP的初始浓度相同,设计如下对比实验探究有关因素对该降解 反应速率的影响。实验测得p-O的浓度随时间变化的关系如下图。
2
下列结论或推断不正确的是 A.实验①、②表明温度升高,降解反应速率增大
B.pH等于10时,降解速度最快
C.实验过程中取样分析浓度时可以迅速加碱调至pH=10
D.根据反应原理推断,温度过高,双氧水分解会使降解速率变慢 14.下列溶液中各微粒的浓度关系正确的是
--
A.常温下,将0.1mol·L1NH4CI溶液与0.05mol·L1NaOH溶液等体积混合:
-++-+
c(C1)>c(Na)>c(NH4)>c(OH)>c(H)
-+-
B.在小苏打溶液中存在:c(HCO3)=c(Na)-c(CO32)-c(H2CO3)
C.向CH3COOH溶液中加入适量的NaOH,得到pH=4的混合溶液:
+-+-
c(Na)>c(CH3COO)>c(H)>c(OH)
D.pH=3的一元酸HX和PH=11的一元碱MOH等体积混合:
+-+
c(M)=c(X)>c(H)=c(OH-)
15.在恒温恒容的密闭容器中,发生反应3A(g)+B(g) xC(g)。
Ⅰ.将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a; Ⅱ.若起始时A、B、C投入的物质的量分别为nA、nB、n C,平衡时C的体积分数也为a 下列说法正确的是 A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大 B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4 C.若x=2,则Ⅱ体系起始物质的量应当满足3nB=nA+3 D.若Ⅱ体系起始物质的量满足3nC +8 nA=12 nB时,可判断x=4 二、(本题共2小题,共16分) 16.(9分)实验室用乙酸和正丁醇制备乙酸正丁酯,有关物质的相关数据如下表:
合成和提纯步骤为:
第—步,正丁醇和冰醋酸混合加热发生酯化反应,反应装置如右上图;第二步,用 饱和Na2CO3溶液、水洗涤,干燥;第三步,蒸馏提纯。 请回答有关问题:
(1)第一步装置中除了加正丁醇和冰醋酸外,还需加入_________,_________;它们
的作用分别是___________、___________,装分水器的作用是___________。 (2)第二步用饱和Na2CO3溶液洗涤的目的是_____________________,此步操作用到
的主要仪器的名称是______________。
3
(3)第三步蒸馏产品时,应收集温度在_______左右的馏分。如加入18.5mL正丁醇和
15.4mL冰醋酸,得到乙酸正丁酯12.76g,则乙酸正丁酯的产率为___________。
17.(7分)绿矾(FeSO4·7H2O)在医药和染料生产中有广泛应用。下面是以铁屑(含少量锡
等杂质)生产绿矾的一种方法:
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。 (1)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是____________________________;
+
通入硫化氢至饱和的目的是:①除去操作I所得溶液中含有的Sn2等杂质离子; ②____________________。
(2)操作Ⅳ的顺序依次为:______________、冷却结晶、________________。 (3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸
等杂质;②____________________。
+
(4)测定绿矾产品中Fe2含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL
容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的
-
0.0100mol·L1 KmnO4溶液滴定至终点,消耗KMnO,溶液体积的平均值为20.00mL。
+-+++
(滴定时发生反应的离子方程式为:5Fe2+MnO4+8H=5Fe3+Mn2+4H2O) 则上述样品中FeSO4·7H2O的质量分数为____________。 三、(本题共3小题,共24分) 18.(7分)金属铬硬度大,抗腐蚀性强,有光泽,在金属材料和结构理论等领域中有着重
要的应用和超乎寻常的发现。1994年,在秦始皇兵马俑二号俑坑中发现了一批青铜剑,它们在黄土下沉睡了2000多年,出土时却光亮如新,锋利无比。科研人员测试后发现,剑的表面有一层10微米厚的铬盐化合物。这一发现立刻轰动了世界,因为这种铬盐氧化处理方法是近代才出现的先进工艺。 (1)铬的独特化学性质与其电子结构有密切关系,写出Cr的价层电子排布_________,
-
铬的这一电子排布与其同一周期的其它元素的3d1104s2价电子排布不同,原因是 ____________________________________。
(2)铝热法是用三氧化二铬作原料,铝粉作还原剂生产金属铬的主要方法之一,请写出其化学反应方程式:____________________________________;这是一个自发放热反应,由此可判断铬氧键和铝氧键中________________键更强。
(3)在结构化学中,对多重键的研究具有重要意义。常见的多重键有双键和三键,2005年11月,美国Science杂志发表了Power等人的文章,报导了 一种具有Cr Cr五重键的稳定化合物,这是目前发现的最 短的铬—铬键。结构见右图。
化学键的形成可以通过对称性形象地描述为:
σ键是成键原子轨道头对头形成的;肩并肩形成的是π键,而面对面形成的是δ键。那么,在上述具有Cr Cr五重键的化合物中,对其成键情况进行分析发现Cr原子的价层电子排布特点是其成键情况的决定因素,它利用其4s轨道去与相邻的C原子形成Cr-C σ键,5个d轨道形成五重键,其中两个铬原子的dz2轨道沿着z轴方向形成一个σ键。则轨道dx2-r2和dxy面对面形成两个____键,轨道dxz和dyz肩并肩形成两个____键。 19.(15分)氢能被视为21世纪最具发展潜力的绿色能源,其燃烧产物为水,无污染。氢
-
气燃烧的热值很高,为1.4×105 kJ·kg1,是汽油的三倍。它既可以通过燃烧产生热能,进而通过热机转化为机械功;也可以通过燃料电池直接转化为电功。热机的能量转换效率有一个理论上限——卡诺效率η=1-T低温/T高温;而燃料电池的能量转换效率在理想情况下为100%,据报道,目前的氢燃料电池的转化效率已达到85%以上,也就是说,大于85%的化学能可以转化为电能。 (1)写出酸式氢氧燃料电池的电极反应:
负极:__________________________,正极:__________________________, 电池反应:____________________________________________。
(2)设氢氧燃料电池效率为85%,则每消耗1kg氢气可提供的电能为________KJ。 (3)燃烧1kg的氢气所放出的热量,通过一个在高低温热源温度分别为1000K及300K 间工作的热机做功,可带动发电机发_________kJ电(设发电机效率为80%)。 20.(12分)工业合成氨与制备硝酸可采用如下流程进行联合生产:
(1)右图表示了298K时氮气与氢气合成氨反应过程中的能量变化。对于合成氨的反应 下列说法正确的是_____________ (填编号)。 a.该反应在任意条件下都可以自发进行
b.加入催化剂,能使该反应的E和△H都减小
c.若该反应在298K、398K时的化学平衡常数分 别为K1、K2,则K1>K2
d.该反应属于人工固氮 (2)在800℃时,氨与氧气在氨氧化炉中反应的主要产物是NO和H2O。在实际生产
中氨的氧化率与混合气中氧氨比{氧气与氨气物质的量比,以γ[n(O2)/n(NH3)] 表示}的关系如下图所示。
①在实际生产中,将γ值维持在数值___________之间为好。 ②在实际生产中,通入氨氧化炉的是空气,若使氨的氧化率达到95%,应控制氨在氨、 空气混合气体中的体积分数约为___________ (设氧气占空气的体积分数为20%)。
5
(3)由于二氧化氮不能被水完全吸收,因此生成的气体须经过多次氧化、吸收的循环操作,使其充分转化为硝酸(如果不考虑生产过程中的其它损失)。 ①从理论上分析,要使氨气完全转化为硝酸,则原料氨气和氧气物质的量的投料比至 少为______________________。 ②如果按理论上的原料比将原料放在一个具有反应条件的密闭容器中进行,所有物质 不与外界交换,则最后所得溶液的质量分数为___________。 ③循环操作的次数与二氧化氮生成硝酸的转化率具有一定的数学关系。计算一定量的 二氧化氮气体大约要经过_________次循环操作,才能使二氧化氮的转化率约为96%。 四、(本题共1小题,共12分) 21.(12分)阿司匹林能迅速解热、镇痛。长效缓释阿司匹林可在体内逐步水解而疗效更佳。用丙酮为主要原料合成长效缓释阿司匹林的流程如下图。
回答下列问题:
(1)上述合成化合物C的路线曾用作有机玻璃单体(2-甲基丙烯酸甲酯)合成路线的一 部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一 氧化碳存在下,于60℃、6MPa条件下羰基化,一步制得了2-甲基丙烯酸甲酯, 其化学方程式为 ;
如此改进的优点为 ;由B到C的反应类型为 反应。 (2)B、C的结构简式分别为:B_________________,C__________________。 (3)阿司匹林的结构简式为______________________。
(4)长效缓释阿司匹林结构简式为_________________________________。 五、(本题共1小题,共8分) 22.(8分)某天然碱可以看作是CO2和NaOH反应后的产物。欲测定该物质的成分,进行如下实验:
(1)称取质量为m的天然碱样品,加入100.00mL过量稀盐酸,产生标准状态下1763mL CO2气体。
(2)另称取同样质量的天然碱样品,在300℃下加热至分解完全,产生标准状态下CO2 293.8mL和1.180g水。
试通过计算,确定天然碱的化学式,并计算m的数值。

